近日,中國科學(xué)院合肥物質(zhì)院強(qiáng)磁場中心王俊峰研究員團(tuán)隊(duì)提出針對惡性瘧原蟲可變抗原的受體嵌合式抗體的體外開發(fā)新策略。相關(guān)成果發(fā)表在Science China Life Sciences上。
瘧疾是一種由瘧原蟲感染引起,經(jīng)蚊媒傳播的傳染病,目前仍是一項(xiàng)全球重大公共衛(wèi)生挑戰(zhàn)。世界衛(wèi)生組織最新的《世界瘧疾報告》顯示,2023年全球2.49億人感染瘧疾,死亡人數(shù)高達(dá)60.8萬。由于惡性瘧原蟲對多種一線藥物產(chǎn)生不同程度的耐藥性,新型抗瘧藥物的開發(fā)刻不容緩。
免疫逃逸是瘧原蟲逃脫宿主免疫攻擊的主要方式。近年來,人們在瘧疾患者體內(nèi)發(fā)現(xiàn)了一類新型抗體,即受體嵌合式抗體。這類抗體在可變區(qū)插入免疫抑制性受體(如: LILRB1或LAIR1)的功能片段,能夠特異性識別表達(dá)在宿主紅細(xì)胞表面的瘧原蟲可變抗原RIFINs,進(jìn)而有效阻斷RIFNs與免疫抑制性受體之間的相互作用,阻止瘧原蟲的免疫逃逸。因此,這類新型抗體在瘧疾治療中展現(xiàn)出很好的應(yīng)用前景。然而,目前該類抗體均是從瘧疾康復(fù)者血液中分離鑒定獲得,存在種類少、分離鑒定困難、親和力不高等問題,限制了其實(shí)際應(yīng)用。
針對這一問題,研究團(tuán)隊(duì)運(yùn)用基于蛋白質(zhì)結(jié)構(gòu)的親和力成熟與酵母高通量篩選技術(shù),提出在體外快速開發(fā)高親和力受體嵌合式抗體的新策略,用于開發(fā)抑制瘧原蟲免疫逃逸的高親和力人工抗體。基于該策略,團(tuán)隊(duì)開發(fā)出針對惡性瘧原蟲抗原RIFIN#1 (PF3D7_1254800)的高親和力LILRB嵌合式抗體D1D2.v-IgG。生化實(shí)驗(yàn)顯示,與天然型LILRB1相比,D1D2.v-IgG對RIFIN#1的結(jié)合親和力提高了30倍,能夠有效阻斷LILRB1與RIFIN#1之間的相互作用,且生物穩(wěn)定性優(yōu)異。細(xì)胞和寄生蟲免疫學(xué)實(shí)驗(yàn)進(jìn)一步表明,D1D2.v-IgG能夠特異性識別K562細(xì)胞模型和惡性瘧原蟲感染紅細(xì)胞(IEs)表面表達(dá)的RIFIN#1抗原,并有效抑制RIFIN#1介導(dǎo)的免疫逃逸。
在D1D2.v-IgG的基礎(chǔ)上,團(tuán)隊(duì)綜合了自然殺傷(NK)細(xì)胞受體NKG2D的單鏈抗體(scFv),研發(fā)出雙特異性抗體NK-biAb。NK-biAb既能阻斷RIFIN#1介導(dǎo)免疫逃逸,又能吸引NK細(xì)胞至靶細(xì)胞周圍,極大程度增強(qiáng)NK細(xì)胞介導(dǎo)的細(xì)胞毒性。本研究為靶向惡性瘧原蟲免疫逃逸的抗體開發(fā)及抗瘧創(chuàng)新藥物研發(fā)提供了新思路。
強(qiáng)磁場中心博士生王弋卓為論文第一作者,王俊峰研究員、吳勃副研究員、趙宏鑫副研究員和中國科學(xué)院上海免疫與感染研究所江陸斌研究員為共同通訊作者。該工作得到了國家重點(diǎn)研發(fā)計劃項(xiàng)目、國家自然科學(xué)基金項(xiàng)目、安徽省重大基礎(chǔ)研究項(xiàng)目、強(qiáng)磁場安徽省實(shí)驗(yàn)室等的支持。
論文鏈接:http://engine.scichina.com/doi/10.1007/s11427-024-2914-2
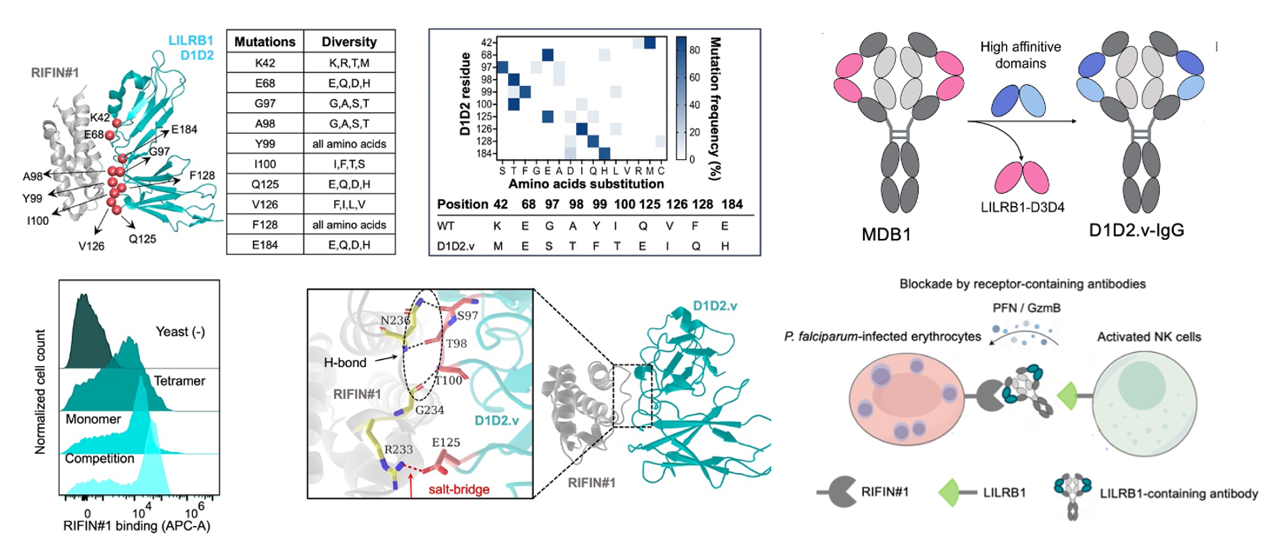
受體嵌合式抗體D1D2.v-IgG的開發(fā)過程及其工作原理

<span id="9mlez"><optgroup id="9mlez"></optgroup></span>